Hvordan virker et pH-meter?
Surheten, eller konsentrasjonen av H+-ioner (egentlig
H3O+) i vann, er en økologisk faktor som
både har betydning for mange biologiske prosesser og som i stor grad
påvirkes av dem. Surheten måler vi som pH, som er den negative
logaritmen til hydrogenion konsentrasjonen (pH=
-log10[H3O+]). Når vann spaltes i
H+ og OH- ioner er alltid
[H+]x[OH-]=10-14. Er det like mye av hvert
ion, sier vi vannet er nøytralt. Da er
[H+]=10-7 og følgelig pH=7. er pH under 7 er
vannet surt, og er det over er det basisk. De fleste organismer i ferskvann
trives best ved pH-verdier rundt nøytralitetspunktet. Allerede ved
pH-verdier under 6 blir det for surt for mange dyr. Likeledes er det mange
vannplanter som får problemer med pH verdier over 9, selv om det er
først rundt pH på 10 at de store problemene melder seg.
pH avgjør
For å vite hvilke forhold planter og dyr lever under i
ferskvann, er det viktig å kjenne pH. Forskjellige teknikker har
vært brukt for å måle den, og den enkleste er basert
på at mange organiske fargestoffer skifter farge når pH
forandrer seg. Har man en ferdiglaget fargeskala for ulike pH verdier, kan
man sette fargestoffet til en vannprøve og sammenligne med skalaen.
Fargestoffet kan også være absorbert på en papirstrimmel,
pH-papir. Når strimmelen dyppes i vann får den farge etter
pH-verdien i vannet. Imidlertid vil fargeindikatorene selv påvirke pH
i vannet. Vann i Norge er som r svært bløtt, hvilket betyr at
det er lite av ulike salter som er løst i det. Dette gjør at
pH er svært labilt og lett påvirkelig. Vi sier det er lite
bufret fordi det er lite med løste salter som stabiliserer pH.
Måler spenning
Langt mer nøyaktig kan pH måles med et med et pH-meter.
I prinsippet er dette et voltmeter som måler spenningen mellom
hydrogenionene i vannet og ionene i glasset på pH-elektroden. Den type
pH-elektroder som brukes ved pH-målinger i vann, er en såkalt
kombinert elektrode (Fig 1), som egentlig er to elektroder montert i samme
holder. Den ene elektroden er en glasselektrode, og den andre en
referanseelektrode.
Prinsippet
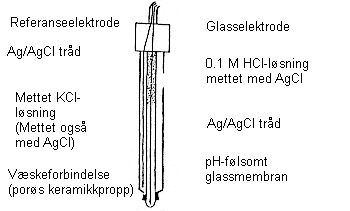 |
| Figur 1 |
For å forstå prinsippet ved målingen er det
enklest å se på de to elektrodene separat (fig. 2). På
glasselektroden er den nedre glassboblen laget av en spesiell type tynt
glass som er følsom for hydrogenkonsentrasjonen i vannet. Det
etableres en likevekt mellom hydrogenionene i vannet og ionene i glasset.
Denne likevekten skaper et elektrisk potensial over kontaktflaten.
Potensialet er avhengig av konsentrasjonen av hydrogenionene i vannet og
temperaturen. Potensialet er ved samme temperatur l avhengig av logaritmen
til ioneaktiviteten, slik at når potensialet er kjent kan man regne ut
pH (Nernsts formel). Det må kalibreres mot en buffer eller to buffere
med kjent pH og det må korrigeres for temperaturen. De fleste
pH-metere kan kalibreres for temperaturen. Glassboblen har en indre 0.1
mol/l HCl løsning. Ned i denne løsningen stikker det en
sølvtråd pålagt AgCl, en sølv-sølvklorid
tråd, som samtidig er i kontakt med ledningen til selve pH-meteret.
Den indre løsningen får på denne måten en konstant
hydrogenion konsentrasjon og et konstant potensiale mot innsiden av
glassveggen. Samtidig blir det en konstant klorid konsentrasjon i
løsningen og et konstant potensiale mot sølv-sølvklorid
tråden. Slik blir det indre potensialet mellom glassveggen og
sølv-sølvkloridtråden konstant.
 |
 |
| Figur 2a | Figur 2b |
Referanse
Det trengs imidlertid en referanseelektrode til for å slutte
kretsen og få en fullstendig elektrokjemisk celle. Referanseelektroden
skal gi et mest mulig stabilt potensiale ved endringer i
hydrogenione-konsentrasjonen vannprøven. Når man måler
potensialet mellom de to elektrodene, måler man summen av alle
potensialene som er nevnt. Blant disse skal alle sammen være konstante
bortsett fra potensialet mellom glasset og vannprøven. Det forandrer
seg med pH'en slik at det kan registreres. Dessverre er det svært
vanskelig å få en referanse elektrode som er helt
upåvirket av hydrogenione-konsentrasjonen i vannprøven.
Måten problemet er løst på er at den indre lederen er
omgitt av en løsning som har et konstant potensiale mot det indre
elementet, sølv-sølvklorid tråden, og tilnærmet
konstant mot vannprøven på utsiden. Vanligvis brukes en mettet
KCl løsning til å omgi Sølv-sølvklorid
tråden. KCl-løsningen står i direkte forbindelse med
vannprøven utenfor gjennom en porøs propp (keramisk, kvarts).
Dessverre gir forskjellig materiale i proppen årsak til noe variasjon
i potensialet mellom vannprøven og elektroden og dette er det
vanskeligste punktet for måling, lagring og vedlikehold av pH
elektroder.
En pH elektrode trenger stadig tilsyn og vedlikehold. Ved bruk
lekker det stadig KCl ut av den porøse proppen og slik væske
må etterfylles. Det er likeledes fare for tiltetning av proppen slik
at referansepotensialet ikke blir riktig. Også glassboblen kan
tilgrises og ved det få feil potensiale. For at elektroden raskt skal
vise riktig potensiale, må både den porøse proppen og
glassboblen være fuktige. Den oppbevaring som anbefales for
kombinasjonselektroder er å holde den nedsenket i pH 4 buffer med noe
KCl krystaller tilsatt. Påfyllingshullet for KCl bør tettes
slik at løsningen ikke fordamper den veien. Holdes hele elektroden i
et reagensrør med en propp som bare har hull for ledningen ut
fordamper heller ikke bufferen elektroden står i. pH elektroder er
dyre og det er lite hjelp i dem hvis de har fått tørke helt ut
den porøse proppen helt tiltettet.
De fleste pH-m har gode bruksanvisninger for bruk, men
for dem som ønsker å sette seg ytterligere inn i pH-meterets
prinsipp, bygning og bruk, anbefales boken:
- Westcott, C. Clark (1978)
- pH Measurements. Academic press.
New York. 172 sider.
|